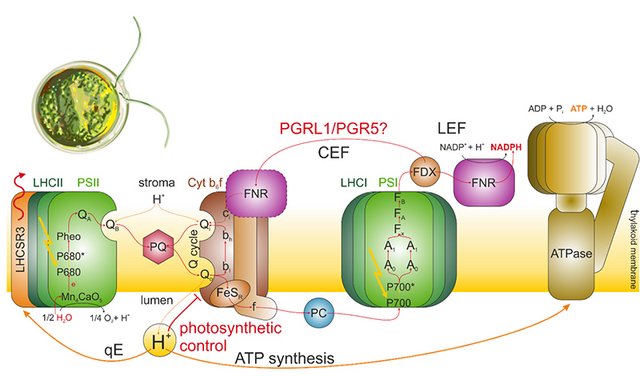
Die einzellige Grünalge Chlamydomonas reinhardtii ist ein beliebter Modellorganismus im Bereich der Photosyntheseforschung. Die Abwesenheit der in eukaryotischen photosynthetischen Organismen konservierten Proteine PGRL1 und/oder PGR5 führt zu einer dramatischen Deregulation des photosynthetischen Elektronentransports. Dennoch ist die Funktion von PGRL1 und PGR5 auf molekularer Ebene bis heute nicht bekannt.
In ihrer Arbeit charakterisierte Laura Mosebach mit Hilfe spektroskopischer und proteinbiochemischer Methoden die physiologische Antwort der PGRL1/PGR5 Knockout Mutanten in C. reinhardtii auf hohe Lichtintensitäten. Außerdem untersuchte sie Elektronentransferprozesse in isolierten Thylakoidmembranen.
Es zeigte sich, dass in den Knockout Mutanten Photosystem I das primäre Ziel von lichtinduzierten Schäden ist. Dies bestätigte die Abwesenheit eines regulatorischen Feedbacks, das im Wildtyp Photosystem I auf Kosten von Photosystem II schützt. Außerdem stellte sich heraus, dass die Menge an mit isolierten Thylakoidmembranen assozierter Ferredoxin:NADP+ Reduktase (FNR) in den Knockout Mutanten reduziert ist. Diese Beobachtung wirft ein neues Licht auf die vielbeschriebenen Phänotypen der Knockout Mutanten.
In Zukunft wird die Frage im Zentrum stehen, inwiefern PGRL1 und PGR5 zur Bindung von FNR an die Thylakoidmembran beitragen – und inwiefern die Bindung von FNR an die Thylakoidmembran photosynthetischen Elektronentransport moduliert.
___
Laura Mosebach fertigte die Arbeit am Institut für Biologie und Biotechnologie der Pflanzen / Lehrstuhl für Pflanzenbiochemie und -biotechnologie in der Arbeitsgruppe von Prof. Dr. Michael Hippler an.